誘起効果( I効果)と共鳴効果(R効果)の教科書:オルト-パラ配向性, メタ配向性の理由を説明する
誘起効果( I効果)と共鳴効果(R効果)の概説
誘起効果と共鳴効果の性質を理解することで、有機化学においての反応を理解するための基礎を知ることが出来る。誘起効果も共鳴効果も似ているように感じるが、σ結合を介しているかπ結合を介しているかで異なってくる。そのため、効果範囲や配向性への影響が異なる。誘起効果と共鳴効果をマスターして、有機化学の根底から理解することを目指しましょう。有機の反応性を理解する上で、分子の電子の動きを知る事が非常に大切です。例えばベンゼン環のオルトパラ配向性やメタ配向性についての理解や中間状態(アニオン・カチオン)の安定性は、電子状態を知る事で理解できます。
今回は、分子の電子状態を知るために誘起効果(I効果)と共鳴効果(R効果)について解説します。
誘起効果(I効果)について
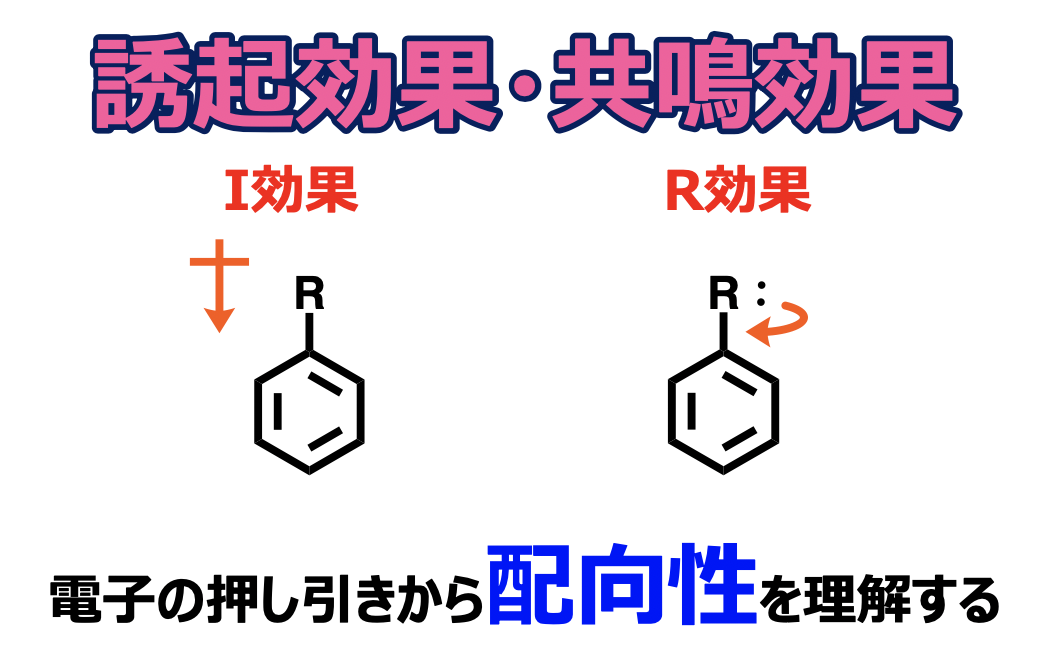
誘起効果は、分子の中でσ結合(単結合に相当する部分)を介して電子を押したり引いたりする効果のことです。電気陰性度(電子を引っ張る力)に対応していて、周期表の右上に近いほど強くなります。また、官能基単位では、下の図に示すような順で決まっている。
分極も誘起効果によって、起こります。電気陰性度のことなる原子同士の結合においては、σ結合の電子密度に偏りが生じます。電子を引っ張る力が強い原子が、電子を引き付けてδ–になります。また、電子を引きつける力が弱い方がδ+になります。このような現象を結合分極と呼びます。
反応への影響
誘起効果が大きい官能基が付いている部分は電子の密度が少なくなり(酸性度UP)、求核攻撃を受けやすくなります。σ結合を介した力であるため、誘起効果を引き起こす官能基が付いている原子への影響は大きいが、遠くの原子への影響は少ない。
共鳴効果(R効果)について:配向性を決定づける
共鳴効果は、分子の中でπ結合(二重結合の二つ目の結合に相当する部分)を介して電子を押したり引いたりする効果のことです。特に共鳴部位を持つ化合物(ベンゼン環等)の反応性を理解するために重要です。また、共鳴によって電子の仮想的な動きで説明することが出来て、I効果よりも遠隔部位に対しても影響を与えることが出来ます。
電子供与基の場合:オルト-パラ配向性
例えば、下の図の様に電子を押し出すメトキシ基の場合は、オルト位とパラ位の電子密度が高くなり、求電子試薬と反応しやすくなります。また、ベンゼン環に対して、電子を押し出しているため、求電子試薬との反応速度も早くなります(反応活性化)。
電子吸引基の場合:メタ配向性
電子吸引基の場合は、オルト位とパラ位の電子密度を下げるため、相対的にメタ位の電子密度が高くなり、求電子剤とはメタ配向性で反応する。また、ベンゼン環から電子を引っ張っているため、求電子試薬との反応速度は遅くなります(反応不活性化)。
ハロゲン基の場合:オルトーパラ配向性
ハロゲン基の場合は、I効果的には、ベンゼン環から電子を引っ張っているので、求電子試薬との反応速度は遅くなります(反応不活性化)。一方でR効果的には、電子を押し出すので、オルト位とパラ位の電子密度が高くなり、オルトーパラ配向性で求電子試薬と反応しやすくなります。
まとめ
誘起効果(I効果)と共鳴効果(R効果)についてまとめました。これらの効果を理解する事でオルト-パラ配向性, メタ配向性や反応の速さの違いがなぜ生まれるのかの理由を説明できます。
誘起効果( I効果)と共鳴効果(R効果)の解説動画
オルト-パラ配向性, メタ配向性の理由を説明するこの記事誘起効果( I効果)と共鳴効果(R効果)の教科書:オルト-パラ配向性, メタ配向性の理由を説明するの解説動画はこちらです。











コメント
コメントを投稿