共鳴構造式とは:概念から書き方・矢印の書き方まで
はじめに
共鳴構造は、大学有機化学の『共役』理解する時に必要な考え方です。R効果の理解や有機反応の途中経過を追う時に必須です。大学でも丁寧に教えているし内容は至極単純だけど、学問の成り立ちが深いから、内容に取り掛かるまでに集中力が削がれてしまって、結果的に理解ができないって状態になってしまいます。と言うことで今回は、共鳴構造について解説する。
共鳴構造をなぜ使うのか
共鳴構造とは、電子の動きを『仮想的に表現したモノ』です。基本的にはオクテッド則から逸脱しない有り得る構造体を書けば良いです。分子は原子同士を電子が繋いでいるのですが、その電子は雲みたいにモヤモヤした存在なので、私たちが構造式を書く時には、結合を『棒』で書います。しかし、棒で書いてしまうと、実際には起きている電子の広がり(動き)を認識することが出来ません。そこで共鳴という考え方を入れることで、電子の動きも『棒』で表せるようになります。結局のところ、電子みたいな不確定なもの(電子の非局在化)を見える様にするための方法が共鳴構造であると思っていれば良いです。
共鳴構造の考え方と書き方
共鳴構造の書き方は、有機反応を考えるときに必須なツールとして考えて良いでしょう。結合という不可視なものを、仮想的に可視化することができるので、共鳴構造式を使いこなすことで、大学の学部レベルの理解だけではなくて、世界最先端の研究まで理解が出来るようになる。つまり共鳴構造式の書き方を理解することで基礎から応用までほぼ全ての有機反応を扱えるようになる。共鳴構造式の書き方は以下のルールに基づいている。
1. 電子2個で棒1本で表記される
2. 多重結合のπ電子に該当する電子(棒)が移動する
電子は、共鳴で移動していると考えられるが、そのときπ結合の中を移動してると考える。σ結合の中は移動できない。構造式では、違いが見えないが、軌道まで考えると混成に参加していないp軌道の中を移動することが見えてくる。混成軌道とp軌道については、別の記事にて解説している。
3. 各原子に対して8個以上の電子が所属することはない。
軌道の中に入れる電子の数は決まっているので、炭素であれば8つ以上の電子が入ることがない。構造を書くときにHを省略しているので、うっかりミスをしてしまうことがある。
4.+の時と−の時の軌道の形をイメージする
電子の入り方で軌道の形が変化することも頭に入れておく。混成していないp軌道でも2つの電子に満たされると、混成軌道になる。電子の動きと軌道の形をリンクすることで、共鳴構造の反応性を理解できる。
5.書ける共鳴構造が多い方が安定
原則として、書ける共鳴構造が多い方が安定である。局所的な電荷の偏り(不安定な状態)が共鳴によって分散されるため、結果的に安定になる。
共鳴構造式の矢印の書き方
共鳴構造は,実際のところは二つの共鳴構造の間を行き来するものではなくて、共鳴混成体(resona'Ice hybrid)という変化しない一つの構造で,二つの描造 の性質を同時にもっている。ただし、反応を考える上で二つの共鳴構造の間を行き来する揺らぎをイメージするとわかりやすい。
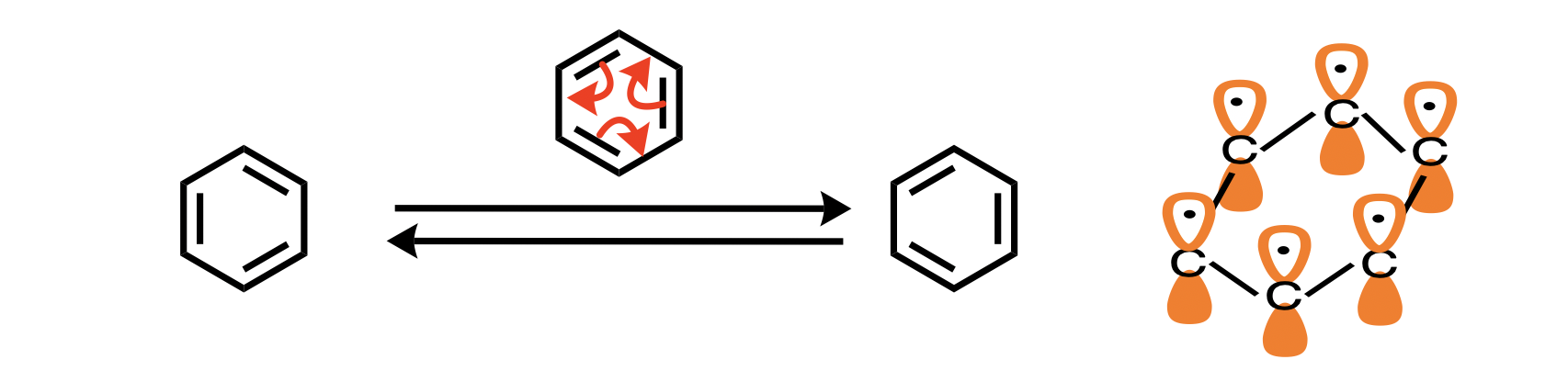
ベンゼンの共鳴構造式
共鳴構造の典型的な例としてベンゼンを以下の図に示します。ベンゼンは、平面に対して垂直にp軌道が並んでいて、その中を電子が非局在化(電子が平均的に存在)している。そのため、反応性が低く非常に安定である。
ベンゼン単独では、電子が偏りなく平均的に存在しているけれど、官能基が結合すると、電子の密度差が現れてくる。
フェノールの共鳴構造
フェノールはOHが電子豊富なのでそこから電子が流れ込んでくる。そして共鳴によってベンゼン環の中を流れるので、ベンゼン環の中に電子豊富は場所が生まれる。一方で、影響が無い場所は、元の電子密度と変わらないのだが、OHの影響を受けた場所と比べると相対的に電子が少ない状態になる。
実際の反応の場合は、フェノールのHが取れて共鳴構造を作ります。直鎖のアルコールと比べて、フェノールの酸性度が高い(Hを放出しやすい)のは、この共鳴構造によって安定化することができるため、Hが取れやすくなっている。その結果として、フェノールは酸性を示します。
アニリンの共鳴構造
アニリンもフェノールとほぼ同じである。アニリンはNが電子豊富なのでそこからベンゼン環に電子が流れ込んでくる。そして共鳴によってベンゼン環の中を電子が流れるので、ベンゼン環の中に電子豊富は場所が生まれる(オルト、パラ)。一方で、影響が無い場所(メタ位)は、元の電子密度と変わらないのだが、Nの影響を受けた場所と比べると相対的に電子が少ない状態になる。→相対的な電子密度の違いは、芳香族の反応選択性に影響する(リンク先参照)
ニトロベンゼンの共鳴構造
ニトロベンゼンはアニリン・フェノールと逆である。ニトロベンゼンはニトロ基(NO2)が電子不足なのでニトロ基にベンゼン環から電子が流れ込んでくる。そして共鳴によってベンゼン環の中に電子不足の場所が生まれる(オルト、パラ)。一方で、影響が無い場所(メタ位)は、元の電子密度と変わらないのだが、ニトロ基の影響を受けた場所と比べると相対的に電子が多い状態になる。→芳香族の反応選択性に影響する(リンク先参照)
まとめ
今回は共鳴構造式に関する解説を行った。電子の濃さに濃淡があったり、電子が伝達したりという考え方は、化学を理解する上で必須であると考えて良い。むしろ、この概念を知らないと、暗記型になってしまい応用が出来ないポンコツ化学者になってしまうので注意しよう。一方で、この考え方をしっかり理解できている人は、今後の学習をスムーズに進めることが出来るので、化学者としてしっかり抑えておきましょう。

















コメント
コメントを投稿