形式電荷とは?
本記事では、形式電荷とは何か。について簡単に説明をする。形式電荷を理解するコトは、有機化学の“反応”を理解することに役立つ。そのため、大学の期末テストでは当然のように出てくる考え方であるし、大学院入試では、形式電荷を理解していないと入試テストの筆記を通過するコトが出来ない。また、既存の反応の解説に多用されるので、有機反応を学習する時に必須の知識になる。それに加えて、研究室等に所属して、新規の反応開発を行うときや、目的化合物を合成する時の反応戦略を作る時にも大切になってくる。一方で、酸化数やオクテッド則と混同してしまうことがあるので、形式電荷・酸化数・オクテッド則の違いについても説明をする。
形式電荷-有機を理解するための必須ツール-
形式電荷を理解するために、形式電荷の定義を簡単に説明したあと、とても覚えにくい形式電荷の計算式について説明し、そのあと形式電荷の考え方を理解するコトで、形式電荷の公式を覚えなくても形式電荷を計算できるようにする。この順で説明をしていく。
形式電荷の定義について
ルイス構造を考える時の形式電荷(Formal charge)は、結合間の電気陰性度による電子の偏りを無視して原子間に電子が均等に共有されていると仮定した時に、各原子に割り当てられた電荷のこと。つまり、原子それぞれに固有の形式電荷がある。そして分子全体の電荷を指すものではない。分子の最良のルイス構造(または支配的な共鳴構造)を決定する場合、各原子の形式電荷ができるだけゼロに近くなるように構造が選択される。形式電荷はその名が示すように【形式的な電荷】であって、分子に実際にイオン電荷があること意味するわけではない。つまり本来は、電荷は連続的に変化するものであるが、それを+やーで無理やり表記すること仮想的な電荷である。そのため実際の分子の電荷の状態とは厳密には異なる。しかし、形式電荷を勉強する意義は非常に重要で、形式電荷は、分子内の電荷の分布を推定するためのツールであり、簡単に有機反応を理解するために必須である。つまり、パソコン等の大型計算機を使わずに、有機化学反応を紙の上で書き出し、その正当性を考える時に必須の考え方が形式電荷である。
形式電荷の計算式
一般的に以下の式で覚えることは出来るが、ただ数を数える作業を式にしただけなので、この式を覚えることは無意味で、本質的に理解して式を覚えずに形式電荷を数える様にした方が良い。
ー正直わかりにくい公式ーWikipediaよりー
形式電荷=(孤立した原子の価電子の数)ー( 結合電子の価電子の数) =(孤立した原子の価電子の数)ー(結合電子の半分)ー(非結合電子の数)
形式電荷を理解する
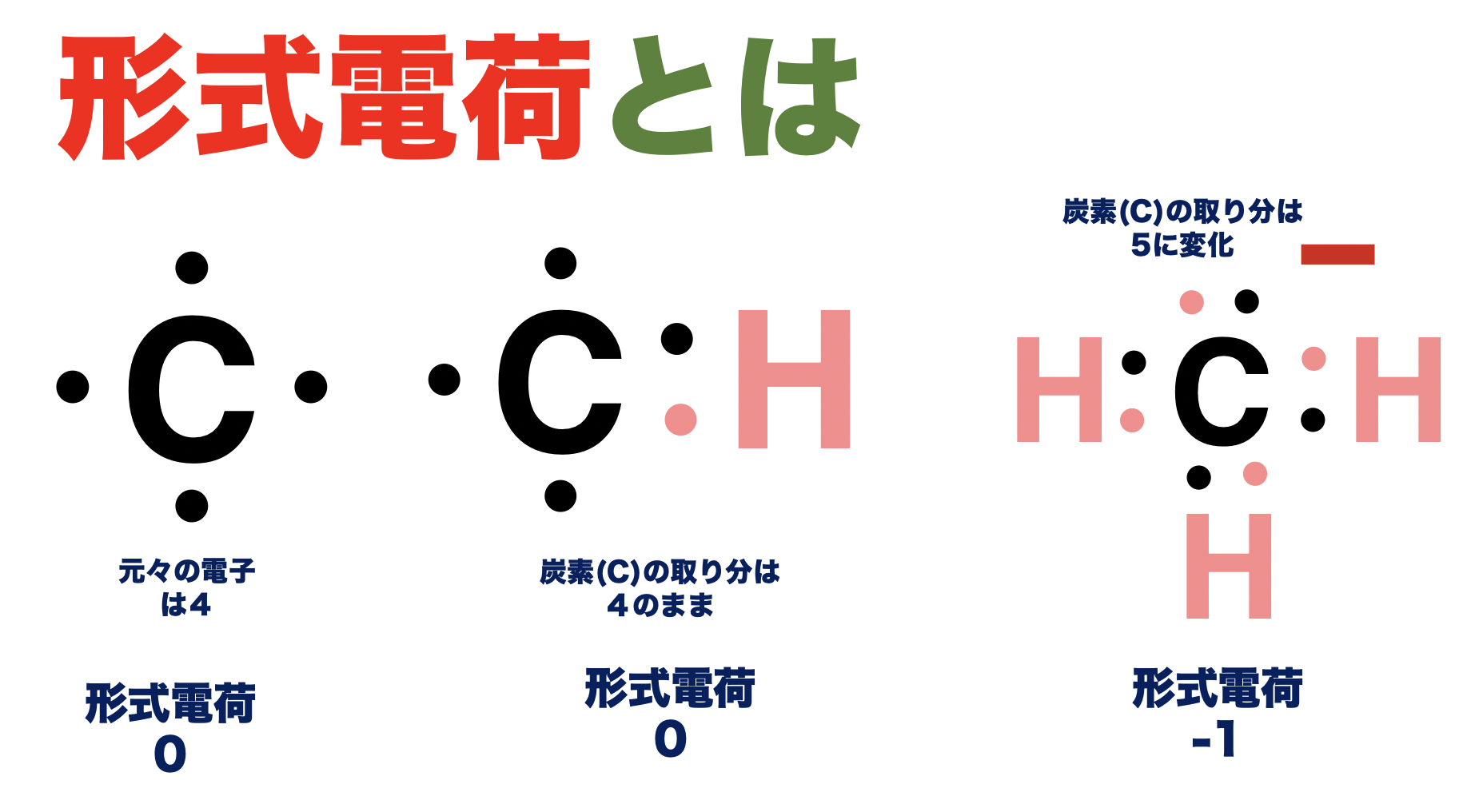
形式電荷の考え方としては、『本来原子が持っている電子との差:電子の取り分』と考えるとよい。『原子』が持つ電子(最外核電子)の個数は、原子ごとに決まっている。通常、原子同士が1電子づつ出して結合をしたとしても原子ごとの電子の取り分は1電子であり変化はしない。この時の形式電荷は、取り分に変化がないので、0である。一方で、通常の原子が作る結合の”手”の本数よりも多く結合している場合や少なく結合している場合には、原子の電子の取り分に変化が起きていることがある。こう言う場合に形式電荷が変化している。形式電荷の数え方のルール
形式電荷は、難しく考えずそれぞれの原子の電子の取り分が本来持つべき電子数とどれだけ違うかを考えればいい。その時にオクテッド則が満たされているかとか、不安定かどうか、と言う考えは、一旦忘れて、とにかく数を数えて元の原子の取り分との差を考えるべし。結合してる原子同士は、電子を半分づつに分け合うので、半分の電子だけ考えれば良い。炭素の形式電荷
炭素の形式電荷について、取り分を考えつつ解説をする。多重結合の場合と形式電荷が変化する場合の2例を示す。多重結合の場合を炭素を使って説明
多重結合は、形式電荷を考える時にミスをしやすいが、原子において電子の取り分を考えると、間違えない。形式電荷が変化する場合
形式電荷が変化する場合は、取り分に変化があった時である。その例を炭素原子の形式電荷をつかって紹介する。その他の形式電荷の例
その他、形式電荷を電子の数を数えながら考えるとこの様になる。形式電荷とオクテット則や酸化数の違い
オクテット則と形式電荷の関係
オクテット則は、それぞれの原子が持っている電子数が8になると安定になるという考え方である。つまり、原子同士が電子を共有して数えるというのが根底にある。それに対して、形式電荷は、それぞれの原子の取り分の電子数を数えるという考え方である。つまり原子同士が電子を共有して数えてはダメと言う考え方である。そしてオクテッド則とはほぼ無関係である。そして、形式電荷が0でも不安定の場合もあるし、形式電荷が+やーでも安定な場合もある。そのため、形式電荷を議論している分子は不安定な状態であることも普通に有り得るのである。
以上のことからオクテッド則と形式電荷を混同してはいけない。
酸化数と形式電荷の関係
酸化数も形式的な数値であり、酸化還元反応での電子数を考える時によく使う。これも形式的な数値で有り、さらに+ーで表記するので、ルイス構造の形式電荷と混同しやすいが全く別物である。つまり酸化数と形式電荷は違うモノである。形式電荷は、結合間の電気陰性度による電子の偏りを無視して原子間に電子が均等に共有されていると仮定しているのに対して、酸化数は、電気陰性度の強さを比較して、強い方に電子が完全に偏っていると仮定する考え方である。
つまり
- 形式電荷:結合では、電子を均等に分けて考える
- 酸化数:結合では、電気陰性度の強い原子に電子を奪われていると考える
酸化数は、原子の電子密度が、単体であるときと比較してどの程度かを知る目安の値である。酸化数は、便宜的なルールに従って決まっていて、電気陰性度の強さを比較して、強い方に電子が偏っていると考える。細かいルールは酸化の項目で説明しているが、簡単に示すと以下のルールに従う。これを踏まえて、酸化数と形式電荷を説明する。














コメント
コメントを投稿