モル(mol)の教科書:わかりやすくモルについて解説
今更聞けないモル(mol)とは?
モルって化学を理解する上で、非常に大切です。とは言っても、分かっている人は分かっているし、分かってない人は、大学でも分かっていないのが現状です。そこで、モルとは何かについて、モル計算のやり方についてわかりやすく解説をしてみました。
『molとは』わかりやすく解説をしてみました。
まずは、モルの定義から触れていきます。
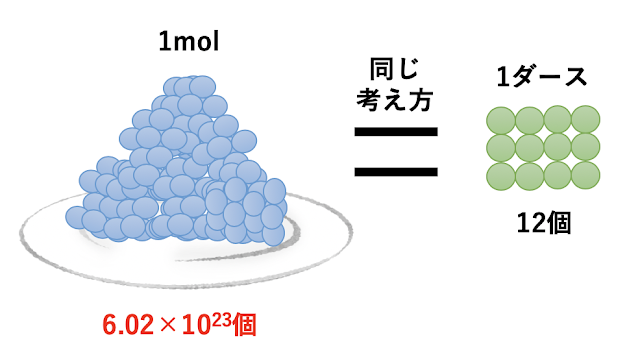
モル(mol)の定義:元素(or 分子)を6.02214076×10^23個をセットにしたら1mol
まずはモルの定義から説明します。モル(記号: mol)は国際単位系 (SI) における物質量の単位である。SI基本単位の一つである。 1モルは正確に6.02214076×10^23の要素粒子又は要素粒子の集合体(組成が明確にされたものに限る。)で構成された系の物質量。
旧定義(2019年までの定義) モルは、0.012 キログラム(12グラム)の炭素12の中に存在する原子の数と等しい要素粒子 (elementary entities) を含む系の物質量である以上がモルの定義です。分子を6.02×10^23個集めると1molになります。ダースと同じと考えてください。
キログラムを使えよ!!って思いますが、キログラムだと化学を実際に使うときに不具合が生じてしまうのです。
なぜモル(mol)が必要なのか?
molの話をすると、グラムを使えばいいじゃんって思いますよね。私も思いましたよ。では、なぜ化学はモルを使わなければいけないのでしょうか。
それは、化学反応は分子(原子)の個数を基準にしているからです。
化学反応の考え方
化学反応は、分子がひとつづつ反応する(した図)。その為に、反応する分子の数を揃えてあげないといけない。しかし実際は、分子の数を数えることは出来ない。そこで『モル(mol)』という考え方が必要になる。
実際の化学反応
実際の化学反応では、分子量(g/mol)を使って、実際に測れる重さ(g)を分子の個数(mol)に合わせる必要がある。そのときに必要になるので、molは必須の考え方。分子の重さと実際の重さ(g)をつなぎ合わせる為の考え方で、炭素(原子量12)を12gにするためには、6.02*10^23個の分子が必要とされている。この数をアボガドロ定数Nと呼ぶ。
どうしても覚えられない人向けのモル計算の覚え方
どうしても覚えられない人向けに、モル計算の覚え方を紹介します。小学生の時にやった速度計算の図を改訂したもの(ネットでみつけたものの改良版)を紹介します。
それが下の絵です。例えば、質量はモル質量×物質量です。質量/物質量はモル質量になります。質量/モル質量は、物質量になります。これで覚えればかなり覚えやすくなります。










コメント
コメントを投稿